Mg. Jesica Díaz* y Lic. Esp. Milagros Ferrando**
Modificaciones nutricionales en los procesos de manipulación de la leche humana extraída
RESUMEN
La importancia de la leche materna para el recién nacido prematuro está bien establecida, sin embargo, la alimentación de estos pacientes suele ser mucho más complicada que el simple acto de amamantar. Las limitadas habilidades para la alimentación oral de muchos recién nacidos prematuros a menudo dan como resultado que la leche materna se administre a través de una sonda de alimentación enteral.
En consecuencia, la propia leche materna debe ser extraída, etiquetada, transportada, almacenada, descongelada, fraccionada, fortificada y administrada al recién nacido con cuidados en cada paso del proceso, para evitar la pérdida de componentes nutricionales como también la contaminación microbiana, la administración incorrecta, los errores de fortificación y el desperdicio.
La finalidad de este artículo es proporcionar un conocimiento global para lograr aplicar prácticas de mejora de la calidad, en lo que respecta a la manipulación segura de la leche humana en las unidades de cuidados intensivos neonatales.
Palabras clave: leche humana, nacimiento prematuro, modificaciones nutricionales, neonatos, nutrición enteral.
ABSTRACT
The importance of breast milk for the premature infant is well established, however, feeding these patients with breast milk is often much more complicated than the simple act of breastfeeding. The limited oral feeding skills of many preterm infants often result in breast milk being given through an enteral feeding tube.
Consequently, breast milk itself must be extracted, la-beled, transported, stored, thawed, fractionated, fortified and administered to the newborn taking care of each step of the process to avoid the loss of nutritional components as well as microbial contamination, in-correct administration, fortification errors and waste.
The purpose of this article is to provide a comprehensive understanding of quality improvement practices for the safe handling of human milk in neonatal intensive care units.
Keywords: human milk, premature birth, nutritional modifications, neonates, enteral nutrition.
Cómo citar:
Díaz Y, Ferrando M. Modificaciones nutricionales en los procesos de manipulación de la leche humana extraída. Rev Enferm Neonatal. Abril 2021;35:15-24.
INTRODUCCIÓN
La importancia de la leche materna para el lactante prematuro está bien establecida.1,2 Sin embargo, la alimentación de recién nacidos prematuros con leche materna suele ser mucho más complicada que el simple acto de amamantar. Las limitadas habilidades para la alimentación oral de muchos recién nacidos prematuros a menudo dan como resultado que la leche materna se administre a través de una sonda de alimentación enteral. Además, la fortificación se requiere comúnmente para promover un crecimiento y desarrollo óptimos, particularmente en los recién nacidos prematuros más pequeños.3,4
En consecuencia, la propia leche materna debe ser extraída, etiquetada, transportada al hospital, almacenada, identificada en cuanto a fecha y hora de vencimiento, descongelada si se ha congelado previamente, fraccionada, fortificada y administrada al recién nacido con cuidados en cada paso del proceso para evitar la pérdida de componentes nutricionales como también la contaminación microbiana, la administración incorrecta (paciente equivocado), los errores de fortificación y el desperdicio.1-5
La importancia de dichos cuidados en la manipulación radica en que la leche humana suministra una fuente única de componentes nutricionales y biológicos y es la alimentación de excelencia para lactantes prematuros y hospitalizados, como así también para lactantes en la mayoría de las circunstancias.6-9
La finalidad de este artículo es proporcionar un conocimiento global para lograr aplicar prácticas de mejora de la calidad en lo que respecta a la manipulación segura de la leche humana en las unidades de cuidados intensivos neonatales.
Diversos estudios analizados en una revisión sistemática Cochrane publicada en el año 2011 por Becker et al., aportaron datos sobre modificaciones en la composición nutricional de la leche humana según el método de extracción utilizado.10
Un estudio informó diferencias respecto a una mayor concentración de sodio y menor concentración de potasio en leche humana extraída a mano en comparación con el uso de una bomba manual o bomba eléctrica. El contenido de proteína fue significativamente mayor en la leche extraída a mano en comparación con el uso de una bomba manual, y fue similar con el uso de bomba eléctrica.11 En la publicación de Garza et al., se observaron mayores volúmenes y concentraciones de grasa en las leches recolectadas usando bomba eléctrica a través de succión intermitente.12
En otro de los estudios los autores concluyeron que se consigue extraer un mayor volumen de leche con una composición más cercana a la leche final de la mamada si se usa una bomba eléctrica en comparación con el uso de una bomba manual.13 En la metodología del estudio no se especifica el tiempo destinado a la extracción; de todos modos, la evidencia científica apunta a que la leche obtenida al finalizar las extracciones tiene mayor cantidad de grasa y por ende mayor aporte calórico.
Según lo observado en el estudio de Foda et al., el masaje de los pechos mejora la calidad de la leche materna al aumentar en forma significativa la concentración de sólidos totales, lípidos, caseína y la energía bruta.14
Los volúmenes de leche pueden verse influidos por la frecuencia de las extracciones, el masaje de los pechos; en el caso de recién nacidos y madres separados al nacer, el inicio temprano de la estimulación luego del parto, puede resultar positivo.13,15-18
Los resultados de la revisión Cochrane apuntan a que el método más adecuado de extracción de leche puede depender del tiempo transcurrido desde el nacimiento, del propósito de la extracción y de la individualidad materna y concluye que, la extracción manual puede ser más adecuada en los primeros días para iniciar el suministro de leche donde los componentes de la leche resultan importantes. Una bomba eléctrica puede ser útil si el objetivo principal es recolectar mayor cantidad de leche.10
CAMBIOS EN LA COMPOSICIÓN DE LA LECHE HUMANA DURANTE EL ALMACENAMIENTO
La leche humana contiene una variedad de componentes biológicamente activos, factores bioactivos, incluyendo inmunoglobulina A secretora, lactoferrina, lisozima y leptina que son importantes debido a su papel en la lucha contra la infección y regulación endócrina.
Además de minimizar el riesgo de contaminación y crecimiento microbiano, las condiciones en el almacenamiento deben preservar los niveles de nutrientes y minimizar la pérdida de componentes biológicamente activos que se encuentran en la leche humana.19,20
• Efecto de la refrigeración sobre los componentes nutricionales de la leche humana
La actividad antioxidante disminuye significativamente después de 48 horas en refrigeración, al igual que las vitaminas C y E. La leche fresca tiene el mayor poder antioxidante, y cuando no está disponible, la leche refrigerada durante 24 horas es mejor que durante 72 horas y es preferible a la leche congelada.21,22
La refrigeración retarda el crecimiento bacteriano, ya que la actividad bactericida de la leche humana se mantiene cuando se conserva en refrigeración durante menos de 72 h. La leche humana fresca tiene mayor actividad bactericida que la leche humana congelada, la actividad bactericida en la leche humana fresca disminuye entre las 48 y 72 h después de la extracción cuando se refrigera a 4 °C, y la concentración de leucocitos también disminuye.23
A partir de las 72 h la actividad bactericida se conserva más cuando se congela (-20 °C) que cuando se refrigera (4 °C).24-28
Hay una discreta disminución del contenido total de proteínas con función nutricional luego de 96 h de refrigeración, pero no se modifica la concentración de proteínas inmunológicas como las inmunoglobulinas, lactoferrina y lisozima. Al cabo de 48 h de refrigeración hay disminución de la concentración de lisina que se considera un marcador de calidad proteica.29-31
En el estudio de Bertino et al., se observa un aumento significativo de la concentración de ácidos grasos secundaria a la hidrólisis de triglicéridos a partir de las 24 h de refrigeración.32 El aumento de los ácidos grasos oxidados y la acidez de la leche suponen una disminución de la calidad de la leche humana.29,30
Mediante la evidencia científica publicada se puede determinar que la conservación de la leche humana en refrigeración, hasta un máximo de 96 h no implica riesgo microbiológico, pero sí altera la calidad nutricional. En el domicilio, este periodo de 96 h debería restringirse, dada la dificultad de mantener las temperaturas citadas con el uso doméstico de los refrigeradores. 29,32 (Tabla 1)

• Efecto de la congelación sobre los componentes nutricionales de la leche humana
La congelación a -20 ºC inhibe el crecimiento bacteriano y el proceso de congelación-descongelación destruye partículas virales de algunos virus patógenos que pueden estar presentes en la leche humana.33-36 Sin embargo, en lo que respecta al mantenimiento de la calidad nutricional, se han descrito algunos efectos negativos de la congelación a -20 ºC.
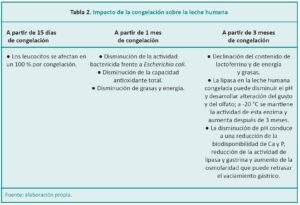
El 100 % de los leucocitos presentes en la leche humana se destruyen tras dos semanas de congelación.37,38
Se produce una declinación del contenido de lactoferrina luego de 3 meses de congelación. Después de 3 y 6 meses a -20 °C, la disminución promedio en las concentraciones de lactoferrina fueron del 55 % y 65 % respectivamente. La bioactividad de la lactoferrina también disminuyó en forma significativa durante 6 meses.31,39 La lisozima se afecta en mayor medida por la congelación.38
También hay pérdidas de vitamina A, vitamina E, tiamina, riboflavina, piridoxina y vitamina C por congelación, mayores con pasteurización previa.40
La actividad bactericida frente a las bacterias Escherichia coli, Staphylococcus aureus y Pseudomonas aureoginosa de la leche humana disminuyó tras un mes de congelación. Algunas investigaciones sugieren que el almacenamiento en congelación a temperaturas más bajas (-70 °C a -80 °C) resulta en una mayor conservación de la actividad bactericida.41
Este hallazgo ha llevado a sugerir que el almacenamiento a -80 °C puede ser apropiado para mantener la capacidad bactericida para leche humana almacenada más de 1 mes; sin embargo, el almacenamiento a estas temperaturas no es común en el ámbito hospitalario y, en general, sólo se utiliza en entornos de laboratorio.24
La capacidad antioxidante total de la leche humana disminuye de modo significativo tras permanecer un mes congelada. A los dos meses de congelación aumenta la peroxidación lipídica. Además, hay una disminución de la concentración total de triglicéridos justificada por la persistencia de la actividad de la lipasa durante la congelación a esta temperatura.42
La lipasa en la leche humana congelada puede disminuir el pH y desarrollar alteración del gusto y del olfato de la misma. La actividad de esta enzima se mantiene a -20 °C y aumenta después de 3 meses.43
La disminución de pH conduce a una reducción de la biodisponibilidad de Ca y P, reducción de la actividad de lipasa y gastrina y aumento de la osmolaridad que puede retrasar el vaciamiento gástrico.43
El sabor rancio en la leche humana congelada se debe a productos de la lipólisis. La lipólisis se debe a la hidrólisis de los lípidos por la lipasa en forma de ácidos grasos libres y glicerol.42
El estudio de Hung et al., reveló que el índice de acidez, los ácidos grasos totales, el ácido cáprico (C10:0) y el ácido láurico (C12:0) de la leche humana aumentaron con el tiempo de almacenamiento, y esa concentración en las muestras de leche congelada de 30 días fue significativamente mayor que a los 7 días de congeladas y que en la leche humana fresca.42
En base a la evidencia publicada se recomienda que cuando los RN rechacen la leche descongelada, las madres deberían proporcionar leche recién extraída siempre que sea posible o proporcionar leche materna congelada por menos de 7 días.42
En comparación con la leche recién extraída, la leche humana congelada durante 1 mes o más tiempo tuvo una reducción de los macronutrientes. La grasa y la energía disminuyen en su mayor cantidad en los primeros 7 días y después continúan disminuyendo a una velocidad más lenta a través de 90 días de almacenamiento en el congelador.44
La evidencia científica que midió la citotoxicidad in vitro sugiere que puede haber beneficios en la reducción del tiempo de almacenamiento en el freezer a -20 °C a un tiempo máximo de 3 meses, ya que mayor tiempo puede ser causa del potencial aumento del riesgo de daño a las células epiteliales intestinales a partir de ácidos grasos libres.45,46
La concentración de ácidos grasos libres no unidos se correlaciona con citotoxicidad; los efectos citotóxicos aumentan después de 8 semanas de almacenamiento a -20 °C.46 La congelación a -80 °C disminuye los cambios citotóxicos y mantiene la capacidad antioxidante del calostro.45-47
En el estudio de Howland et al., se examinó el impacto de diferentes condiciones de almacenamiento sobre la estabilidad del peptidoma de la leche humana.
La leche se congeló directamente a -80 °C o se almacenó a -20 °C (120 h), 4° C (6 h) o temperatura ambiente (durante 6 o 24 h). La varianza del peptidoma aumentó con la temperatura y el tiempo de almacenamiento y varió para diferentes péptidos. El mayor impacto se observó cuando las muestras se almacenaron a temperatura ambiente. Se observaron efectos más pequeños pero significativos en muestras almacenadas a 4 °C, mientras que las muestras mostraron una mayor similitud entre las que se congelaron inmediatamente a -80 °C con las que se almacenaron a -20 °C. Los resultados sugirieron una degradación de proteínas/producción de péptidos en curso por las proteasas derivadas de la leche. Subrayaron la necesidad de la congelación inmediata de leche humana a -20 °C o -80 °C para evitar la degradación de los péptidos.48
Respecto a los envases para almacenar la leche humana extraída se recomienda la utilización de recipientes rígidos en lugar de bolsas de almacenamiento. Los envases de polipropileno no aumentan la pérdida de grasa por adherencia a las paredes del recipiente en la leche congelada en comparación con las bolsas de almacenamiento, que además son propensas a la rotura y fugas y son difíciles de manejar durante la preparación.1 (Tabla 2)
SUPLEMENTACIÓN DE LA LECHE HUMANA
Para optimizar los aportes nutricionales y así mejorar el crecimiento y desarrollo de los recién nacidos prematuros, se han diseñado fortificadores de leche humana que aportan energía, proteínas, minerales y vitaminas. La mayoría son preparados multicomponentes derivados de leche bovina (en polvo y líquidos), aunque también en otros países se dispone de fortificadores a base de leche humana donada pasteurizada y algunos módulos que aportan únicamente un componente (proteína, lípidos o hidratos de carbono). El uso de estos preparados se puede realizar de manera estándar (como lo indica el fabricante) o individualizada.1
Los dos métodos propuestos para individualizar fortificación son la fortificación dirigida y la fortificación ajustable. La fortificación dirigida se basa en el análisis periódico de la leche humana con un instrumento específico (analizador de leche humana) y la fortificación ajustable parece ser más práctica y se basa en la respuesta metabólica infantil, medida por determinaciones del nitrógeno ureico en sangre y, en general, por otros índices nutricionales.1
Siempre que sea posible, deben utilizarse opciones estériles para la fortificación de la leche materna. En la actualidad, se desconoce el período de tiempo óptimo entre la preparación y la administración de la leche materna enriquecida.46
La investigación ha demostrado que, con el tiempo, la osmolalidad de la leche humana fortificada aumenta hasta en un 4 % y el tamaño de los glóbulos de grasa de la leche puede alterarse. posiblemente afectando la digestión de las mismas.49
Si bien acortar el tiempo de almacenamiento de la leche materna enriquecida puede resultar ventajoso, no hay suficiente evidencia publicada para sugerir una revisión de las recomendaciones actuales, que sea un máximo de 24 h.46
La fortificación centralizada de la leche materna es una práctica recomendada y ha demostrado que mejora la seguridad del paciente.9,46
Respecto al efecto de la fortificación sobre la osmolalidad de la leche humana, en el estudio de Lamport et al., se cuantificó la osmolalidad de la leche materna mezclada con fortificantes de leche materna (FLH) disponibles comercialmente y con fórmula infantil en polvo, como se administra actualmente a recién nacidos prematuros, para simular las prácticas estándares de alimentación de la unidad de cuidados intensivos neonatales para mezclar y almacenar en el refrigerador.50
El FLH aumentó significativamente el contenido de micronutrientes y la osmolalidad de la leche humana extraída. Cuando se usaron fórmulas infantiles en polvo para aumentar aún más el contenido calórico de la leche humana fortificada a > 24 kcal/oz, las osmolalidades aumentaron en 10,5-23,0 mOsm/kg por cada kcal/oz adicional. El uso de fórmulas en polvo solas (sin FLH) aumentaron la osmolalidad sin aumentos comparables en el contenido de nutrientes. La refrigeración durante 24 horas no afectó las osmolalidades.50 El estudio llegó a la conclusión de que varias de las formulaciones comunes superan los 450 mOsm/kg, y la falta de evidencia de efectos adversos, plantea la cuestión sobre si las pautas actuales de osmolalidad máxima deben reevaluarse para permitir una nutrición óptima para los recién nacidos en cuidados intensivos neonatales.50
Al momento de seleccionar el fortificador se deben considerar los efectos de la acidificación sobre el contenido celular y nutricional de la leche materna. En el estudio de Erickson et al., se encontró que la acidificación de la leche materna provocó una disminución del 76 % en los glóbulos blancos, del 56 % en la actividad de la lipasa y del 14 % en la proteína total, pero un aumento del 36 % en el crematocrito; se concluyó que la acidificación de la leche materna provoca cambios significativos en los componentes celulares y nutricionales de la leche que pueden no ser beneficiosos para los recién nacidos prematuros.51
La acidificación hace que se reduzca la actividad de la lipasa de la leche. La lipasa de la leche materna ayuda a convertir los triglicéridos en ácidos grasos libres, que son importantes para la digestión de las grasas. La leche materna contiene dos lipasas, una lipoproteína lipasa y una lipasa activada por sales biliares. La lipoproteína lipasa no es estable a pH por debajo de 5.52
Pérdida de nutrientes durante la administración de la leche humana
Los sistemas de infusión (métodos empleados para administrar la alimentación) utilizados para el apoyo de la nutrición enteral en recién nacidos prematuros dan como resultado una reducción significativa de los lípidos de hasta un 40 %, administrados a la vía intestinal. Junto a las pérdidas de lípidos se unen también minerales como calcio y fósforo.53-56
Estas importantes pérdidas de lípidos y de minerales se suman a pérdidas inicialmente más limitadas debidas a la pasteurización, congelación y descongelación.32,57-59
Igawa et al., publicó un estudio que examinó si congelar-descongelar la leche materna es la razón principal de la disminución del contenido de grasa. Además, agregaron una segunda parte a este estudio para determinar si el tamaño y el material del tubo de administración utilizado tuvieron un impacto en la liberación de grasa. El estudio midió el contenido de grasa de la leche materna tanto antes como después de la infusión enteral, y comparó el porcentaje de disminución en la concentración de grasa en cuatro tamaños de tubos diferentes y dos tipos de material (sin PEHD, polietileno de alta densidad, y sin PVC, polivinilo de cloruro), así como el porcentaje de disminución en concentración de grasa. Los resultados encontraron que no hay diferencia en la pérdida de grasa relacionada con los diferentes tamaños o materiales utilizados.60
Además de los efectos cuantitativos de las pérdidas de lípidos, también hay algunas observaciones sobre los efectos cualitativos, ya que también se ha descrito la adherencia de los ácidos grasos de cadena media a los tubos de alimentación durante la alimentación por sonda para la leche materna enriquecida.61
En el estudio de Tabata et al., se ilustró la pérdida de grasa en la leche materna, la influencia de los nutrientes añadidos y el método de infusión.62 La pérdida de grasa fue mayor cuando la leche materna se administró con una bolsa de alimentación vertical, en comparación con el método de infusión a través de una jeringa. Siempre que sea posible, se prefiere el menor tiempo de infusión (por ejemplo, por gravedad). Para aquellos recién nacidos que no parecen tolerar la alimentación, el estudio de Tabata proporciona evidencia de que la adición de fortificante de la leche materna (FLH y/o crema) aumenta la concentración de grasa de la leche materna cuando se administra en una infusión de una hora. El 80 % de las pérdidas relativas de grasa se deben a las técnicas de administración.63
Otro punto que es importante mencionar es que se libera más grasa cuando la punta de la jeringa apunta en posición vertical. La grasa es menos densa que la leche, e inclinar la punta hacia arriba permitirá que la grasa suba a la parte superior y salga primero. La Asociación de Bancos de Leche Materna de Norteamérica (HMBANA) recomienda minimizar la pérdida de grasas y nutrientes durante la alimentación por sonda mediante el uso de “sistemas de infusión de leche con la punta de la jeringa hacia arriba”.64
En el estudio de García-Lara et al., concluyeron que cuando la leche humana es infundida a un ritmo continuo con una bomba de alimentación enteral, se observa una menor pérdida de grasa cuando las jeringas que contienen la leche humana son agitadas cada hora.65
CONCLUSIÓN
La calidad de la leche humana implica la preservación de sus componentes nutricionales (macronutrientes y micronutrientes) y sus componentes bioactivos.
Una manipulación segura de la leche humana desde el proceso de extracción hasta la administración en las unidades de cuidados intensivos neonatales es fundamental.
Conocer el impacto de los diferentes procesos (extracción, almacenamiento, suplementación, administración) sobre la calidad nutricional de la leche humana es clave para la evolución de los recién nacidos prematuros o enfermos.
AGRADECIMIENTOS
A la Bromatóloga Adriana Yannelli por los aportes realizados para la elaboración del presente artículo.
* Licenciada en Nutrición. Magíster en Nutrición y Biotecnología Alimentaria. Especialista en Nutrición Pediátrica. Pasante Profesional del Servicio de Neonatología, Hospital J.B. Iturraspe, Santa Fe. Universidad Juan Agustín Maza, Mendoza, Argentina.
** Licenciada en Nutrición. Especialista en Nutrición Materno Infantil, Hospital Mira y López, Santa Fe. Universidad del Litoral, Argentina.
Correspondencia: nutjesicadiaz@gmail.com
Recibido: 30 de enero de 2021.
Aceptado: 1 de marzo de 2021.
Bibliografía
1. Steele C, Collins E, eds. Infant and Pediatric Feedings: Guidelines for Preparation of Human Milk and Formula in Health Care Facilities. 3rd ed. Chicago, IL: Academy of Nutrition and Dietetics. 2018.p.1-248.
2. Moro GE, Arslanoglu S, Bertino E, Corvaglia L, et al. Human Milk in Feeding Premature Infants: From Tradition to Bioengineering: Proceedings of a Consensus Development Conference-EXPO 2015 Milan, Italy, May 15-16. J Pediatr Gastroenterol Nutr. [Internet]. 2015; 61(Suppl 1):S1.
3. Steele C, Czerwin A, Bixby C. Breast milk bar code scanning results in time savings and staff efficiency. J Acad Nutr Diet. 2015; 115(1):23-6.
4. Steele C, Bixby C. Centralized breastmilk handling and bar code scanning improve safety and reduce breast-milk administration errors. Breastfeed Med. 2014; 9(9):426-9.
5. Oza-Frank R, Kachoria R, Dail J, Green J, et al. A Quality Improvement Project to Decrease Human Milk Errors in the NICU. Pediatrics. 2017; 139(2):e20154451.
6. Section on Breastfeeding. Breastfeeding and the use of human milk. Pediatrics. 2012; 129(3):e827-41.
7. Lessen R, Kavanagh K. Position of the academy of nutrition and dietetics: promoting and supporting breastfeeding. J Acad Nutr Diet. 2015; 115(3):444-9.
8. Moro GE, Arslanoglu S, Bertino E, Corvaglia L, et al. XII. Human Milk in Feeding Premature Infants: Consensus Statement. J Pediatr Gastroenterol Nutr. 2015; 61 (Suppl 1):S16-19.
9. Spatz DL, Edwards TM. The Use of Human Milk and Breastfeeding in the Neonatal Intensive Care Unit: Position Statement 3065. Adv Neonatal Care. 2016; 16(4):254.
10. Becker GE, Cooney F, Smith HA. Methods of milk expression for lactating women. Cochrane Database Syst Rev. 2011; (12):CD006170.
11. Pessoto MA, Marba STM. Is a high quality expressed breast milk, according to expression method, possible for the premature baby in a third world country? Pediatric Academic Societies’ 2010 Annual Meeting; 2010.
12. Garza C, Johnson CA, Harrist R, Nichols BL. Effects of methods of collection and storage on nutrients in human milk. Early Hum Dev. 1982; 6(3):295-303.
13. Kent JC, Mitoulas LR, Cregan MD, Ramsay DT, et al. Volume and frequency of breastfeedings and fat content of breast milk throughout the day. Pediatrics. 2006; 117(3):e387-395.
14. Foda MI, Kawashima T, Nakamura S, Kobayashi M, Oku T. Composition of milk obtained from unmassaged versus massaged breasts of lactating mothers. J Pediatr Gastroenterol Nutr. 2004; 38(5):484-7.
15. Furman L, Minich N, Hack M. Correlates of lactation in mothers of very low birth weight infants. Pediatrics. 2002; 109(4):e57.
16. Hopkinson JM, Schanler RJ, Garza C. Milk production by mothers of premature infants. Pediatrics. 1988; 81(6):815-20.
17. Jones E, Dimmock PW, Spencer SA. A randomised controlled trial to compare methods of milk expression after preterm delivery. Arch Dis Child Fetal Neonatal Ed. 2001; 85(2):F91-5.
18. Morton J, Hall JY, Wong RJ, Thairu L, et al. Combining hand techniques with electric pumping increases milk production in mothers of preterm infants. J Perinatol. 2009; 29(11):757-64.
19. Chang JC, Chen CH, Fang LJ, Tsai CR, et al. Influence of prolonged storage process, pasteurization, and heat treatment on biologically-active human milk proteins. Pediatr Neonatol. 2013; 54(6):360-6.
20. Raoof NA, Adamkin DH, Radmacher PG, Telang S. Comparison of lactoferrin activity in fresh and stored human milk. J Perinatol. 2016; 36(3):207-9.
21. Hamosh M, Ellis LA, Pollock DR, Henderson TR, Hamosh P. Breastfeeding and the working mother: effect of time and temperature of short-term storage on proteolysis, lipolysis, and bacterial growth in milk. Pediatrics. 1996; 97(4):492-8.
22. Păduraru L, Dimitriu DC, Avasiloaiei AL, Moscalu M, et al. Total antioxidant status in fresh and stored human milk from mothers of term and preterm neonates. Pediatr Neonatol. 2018; 59(6):600-5.
23. Ahrabi AF, Handa D, Codipilly CN, Shah S, et al. Effects of Extended Freezer Storage on the Integrity of Human Milk. J Pediatr. 2016; 177:140-3.
24. Takci S, Gulmez D, Yigit S, Dogan O, et al. Effects of freezing on the bactericidal activity of human milk. J Pediatr Gastroenterol Nutr. 2012; 55(2):146-9.
25. Silvestre D, López MC, March L, Plaza A, Martínez-Costa C. Bactericidal activity of human milk: stability during storage. Br J Biomed Sci. 2006; 63(2):59-62.
26. Polberger S, Räihä NC, Juvonen P, Moro GE, et al. Individualized protein fortification of human milk for pre-term infants: comparison of ultrafiltrated human milk protein and a bovine whey fortifier. J Pediatr Gas-troenterol Nutr. 1999; 29(3):332-8.
27. Polberger S, Lönnerdal B. Simple and Rapid Macronutrient Analysis of Human Milk for Individualized Fortification: Basis for Improved Nutritional Management of Very-Low-Birth-Weight Infants? J Pediatr Gastroenterol Nutr. 1993; 17(3):283-90.
28. Pittard WB, Bill K. Banca de leche materna: efecto de la refrigeración en componentes celulares. Clin Pediatr (Phila). 1981; 20(1):31-3.
29. Slutzah M, Codipilly CN, Potak D, Clark RM, Schanler RJ. Refrigerator storage of expressed human milk in the neonatal intensive care unit. J Pediatr. 2010; 156(1):26-8.
30. Miranda M, Gormaz M, Romero FJ, Silvestre D. Estabilidad de la capacidad antioxidante y pH en leche humana refrigerada durante 72 horas: estudio longitudinal. Nutr Hosp. 2011; 26(4):722-8.
31. Silvestre D, Ferrer E, Gayá J, Jareño E, et al. Available lysine content in human milk: Stability during manipulation prior to ingestion. Biofactors 2006; 26:71-9.
32. Bertino E, Giribaldi M, Baro C, Giancotti V, et al. Effect of prolonged refrigeration on the lipid profile, lipase activity, and oxidative status of human milk. J Pediatr Gastroenterol Nutr. 2013; 56(4):390-6.
33. Curtis N, Chau L, Garland S, Tabrizi S, et al. Cytomegalovirus remains viable in naturally infected breast milk despite being frozen for 10 days. Arch Dis Child Fetal Neonatal Ed. 2005; 90(6):F529-530.
34. Maschmann J, Hamprecht K, Weissbrich B, Dietz K, et al. Freeze-thawing of breast milk does not prevent cytomegalovirus transmission to a preterm infant. Arch Dis Child Fetal Neonatal Ed. 2006; 91(4):F288-90.
35. Welsh JK, Arsenakis M, Coelen RJ, May JT. Effect of antiviral lipids, heat, and freezing on the activity of viruses in human milk. J Infect Dis. 1979; 140(3):322-8.
36. Ando Y, Ekuni Y, Matsumoto Y, Nakano S, et al. Long-term serological outcome of infants who received frozen-thawed milk from human T-lymphotropic virus type-I positive mothers. J Obstet Gynaecol Res. 2004 Dec; 30(6):436-8.
37. Liebhaber M, Lewiston NJ, Asquith MT, Olds-Arroyo L, Sunshine P. Alterations of lymphocytes and of antibody content of human milk after processing. J Pediatr. 1977; 91(6):897-900.
38. Lawrence RA. Storage of human milk and the influence of procedures on immunological components of human milk. Acta Paediatr Suppl. 1999; 88(430):14-8.
39. Akinbi H, Meinzen-Derr J, Auer C, Ma Y, et al. Alterations in the host defense properties of human milk following prolonged storage or pasteurization. J Pediatr Gastroenterol Nutr. 2010; 51(3):347-52.
40. Friend BA, Shahani KM, Long CA, Vaughn LA. The effect of processing and storage on key enzymes, B vitamins, and lipids of mature human milk. I. Evaluation of fresh samples and effects of freezing and frozen storage. Pediatr Res. 1983; 17(1):61-4.
41. Grazziotin MCB, Grazziotin AL, Vidal NM, Freire MH de S, da Silva RPGVC. Analysis of the Storage Methods for Raw Human Milk from Mothers with Infants Admitted to a Neonatal Intensive Care Unit, According to Brazilian Regulations. J Hum Lact. 2016; 32(3):446-54.
42. Hung H-Y, Hsu Y-Y, Su P-F, Chang Y-J. Variations in the rancid-flavor compounds of human breastmilk under general frozen-storage conditions. BMC Pediatr. 2018; 18(1):94.
43. Silvestre D, Miranda M, Muriach M, Almansa I, et al. Frozen breast milk at -20 degrees C and -80 degrees C: a longitudinal study of glutathione peroxidase activity and malondialdehyde concentration. J Hum Lact, 2010; 26(1):35-41.
44. García-Lara NR, Escuder-Vieco D, García-Algar O, De la Cruz J, et al. Effect of freezing time on macronutrients and energy content of breastmilk. Breastfeed Med. 2012; 7(4):295-301.
45. Penn AH, Altshuler AE, Small JW, Taylor SF, et al. Effect of digestion and storage of human milk on free fatty acid concentration and cytotoxicity. J Pediatr Gastroenterol Nutr. 2014; 59(3):365-73.
46. Boullata JI, Carrera AL, Harvey L, Escuro AA, et al. ASPEN Safe Practices for Enteral Nutrition Therapy [Formula: see text]. JPEN J Parenter Enteral Nutr. 2017; 41(1):15-103.
47. Akdag A, Nur Sari F, Dizdar EA, Uras N, et al. Storage at −80 °C Preserves the Antioxidant Capacity of Preterm Human Milk. J Clin Lab Anal. 2014; 28(5):415-8.
48. Howland V, Klaedtke M, Ruhnau J, Dhople VM, et al. Impact of Storage Conditions on the Breast Milk Peptidome. Nutrients. 2020; 12(9):2733.
49. Takahashi K, Mizuno K, Itabashi K. The freeze-thaw process and long intervals after fortification denature human milk fat globules. Am J Perinatol. 2012; 29(4):283-8.
50. Lamport L, Hartman C, Codipilly C, Weinberger B, Schanler R. Effects of Nutrition Supplementation on Osmolality of Expressed Human Milk. JPEN J Parenter Enteral Nutr. 2019; 43(6):809-14.
51. Erickson T, Gill G, Chan GM. The effects of acidification on human milk’s cellular and nutritional content. J Perinatol. 2013; 33(5):371-3.
52. Olivecrona T, Hernell O. Human milk lipases and their possible role in fat digestion. Padiatr Padol. 1976; 11(4):600-4.
53. Stocks RJ, Davies DP, Allen F, Sewell D. Loss of breast milk nutrients during tube feeding. Arch Dis Child. 1985; 60(2):164-6.
54. Jarjour J, Juarez AM, Kocak DK, Liu NJ, et al. A Novel Approach to Improving Fat Delivery in Neonatal Enteral Feeding. Nutrients. 2015; 7(6):5051-64.
55. Rogers SP, Hicks PD, Hamzo M, Veit LE, Abrams SA. Continuous feedings of fortified human milk lead to nutrient losses of fat, calcium and phosphorous. Nutrients. 2010; 2(3):230-40.
56. Brennan-Behm M, Carlson GE, Meier P, Engstrom J. Caloric loss from expressed mother’s milk during continuous gavage infusion. Neonatal Netw. 1994; 13(2):27-32.
57. Andersson Y, Sävman K, Bläckberg L, Hernell O. Pasteurization of mother’s own milk reduces fat absorption and growth in preterm infants. Acta Paediatr. 2007; 96(10):1445-9.
58. Montjaux-Régis N, Cristini C, Arnaud C, Glorieux I, et al. Improved growth of preterm infants receiving mother’s own raw milk compared with pasteurized donor milk. Acta Paediatr. 2011; 100(12):1548-54.
59. Vieira AA, Soares FVM, Pimenta HP, Abranches AD, Moreira MEL. Analysis of the influence of pasteurization, freezing/thawing, and offer processes on human milk’s macronutrient concentrations. Early Hum Dev. 2011; 87(8):577-80.
60. Igawa M, Murase M, Mizuno K, Itabashi K. Is fat content of human milk decreased by infusion? Pediatr Int 2014; 56(2):230-3.
61. Mehta NR, Hamosh M, Bitman J, Wood DL. Adherence of medium-chain fatty acids to feeding tubes during gavage feeding of human milk fortified with medium-chain triglycerides. J Pediatr. 1988; 112(3):474-6.
62. Tabata M, Abdelrahman K, Hair AB, Hawthorne KM, et al. Fortifier and Cream Improve Fat Delivery in Continuous Enteral Infant Feeding of Breast Milk. Nutrients. 2015; 7(2):1174-83.
63. Rayyan M, Rommel N, Allegaert K. The Fate of Fat: Pre-Exposure Fat Losses during Nasogastric Tube Feeding in Preterm Newborns. Nutrients. 2015; 7(8):6213-23.
64. Human Milk Banking Association of North America (HMBANA). HMBANA Standards for Donor Human Milk Banking: An Overview. 2020. [Consulta: 05-03-21. Disponible en: https://www.hmbana.org/file_download/inline/95a0362a-c9f4-4f15-b9ab-cf8cf7b7b866.
65. García-Lara NR, Escuder-Vieco D, Alonso Díaz C, Vázquez Román S, et al. Type of homogenization and fat loss during continuous infusion of human milk. J Hum Lact 2014; 30(4):436-41.













