ETIOLOGÍA
Aunque infrecuente, el quilotórax es la principal causa de derrame pleural en el RN. La mortalidad de este proceso es elevada (20-50 %), pero en los últimos años ha disminuido debido a un mejor tratamiento. El quilotórax puede ser primario o congénito, o secundario o traumático. A su vez puede clasificarse en traumático iatrogénico o no iatrogénico.
El quilotórax congénito se presenta cuando hay una linfangiectasia pulmonar congénita primaria o secundaria, defectos obstructivos cardiacos, defectos pulmonares, y rara vez, asociado a cromosomopatías como el síndrome de Turner, síndrome de Noonan, trisomía 21 e hidrops fetal. También puede presentarse en RN con linfangiomatosis y tumores.
Puede ocurrir por defectos congénitos del conducto torácico como ausencia y atresia. El quilotórax congénito es una manifestación común del hidrops fetal no inmune. Se piensa que esta asociación se debe a un desarrollo anormal de los vasos linfáticos. Sin embargo, el quilotórax congénito puede causar hidrops al alterar el drenaje venoso y/o por pérdida de proteínas hacia el espacio pleural causando hipoproteinemia y edema generalizado. La causa del quilotórax neonatal en ausencia de una anomalía linfática identificada no tiene una explicación clara. Siempre que el quilotórax se considere en la categoría de congénito, el mecanismo propuesto es el trauma por ruptura del conducto torácico por hiperextensión de la columna espinal o por aumento de la presión venosa sistémica durante el nacimiento, especialmente en los partos complicados.
El quilotórax no traumático puede deberse a una obstrucción y/o aumento de la presión de la vena cava superior, trombosis, e insuficiencia cardíaca.
El quilotórax traumático se encuentra asociado a cirugía cardíaca, esofágica, mediastinal, diafragmática, pleuropulmonar, y ante un traumatismo obstétrico perinatal.
Dentro de las causas iatrogénicas, se encuentran las que lesionan el conducto torácico, como la cateterización de las venas subclavias y la trombosis de estas, secundaria a la cateterización de una vía central.
El quilotórax es la forma más común de derrame pleural en los primeros días de vida. Puede ocurrir como un hallazgo inesperado en un RN sano, ser detectado antes o después del nacimiento.3-5
FISIOPATOLOGÍA
Las manifestaciones clínicas del quilotórax son el resultado del acúmulo de líquido en el espacio pleural. El neonato puede estar asintomático, pero, al aumentar el tamaño de la efusión pleural, desarrolla taquipnea, dificultad respiratoria, tos y dolor torácico.
El acúmulo rápido de una gran cantidad de líquido puede llevar a complicaciones hemodinámicas con problemas cardiopulmonares importantes como hipotensión, cianosis y dificultad respiratoria grave.
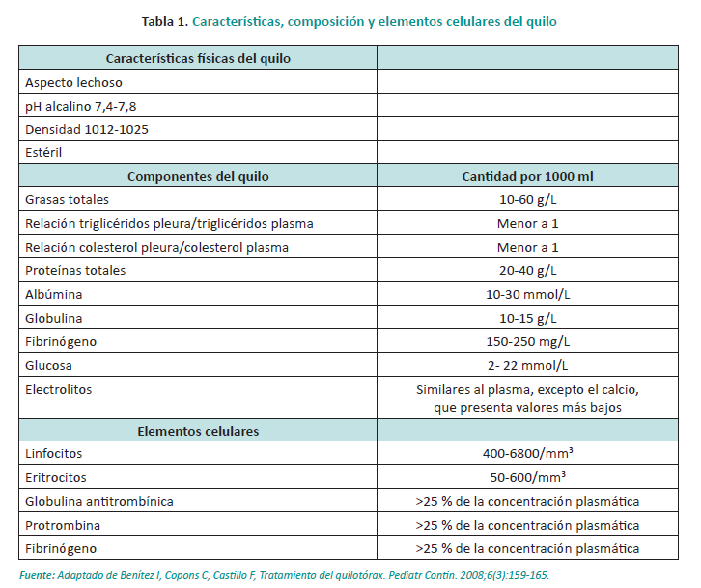
Si el paciente se encuentra en el periodo postquirúrgico y presenta un drenaje pleural, se evidencia el drenaje de un fluido de características lechosa y abundante cantidad.6
Cuando el quilotórax es traumático, puede haber un período de latencia entre 2 a 10 días entre el trauma y el inicio del derrame pleural. La linfa se acumula en la zona extra pleural, en el mediastino, después de la disrupción del conducto torácico y se forma un quiloma que causa una masa mediastínica posterior. Se rompe la pleura mediastínica y el quilo ingresa al espacio pleural; el paciente tiene dificultad respiratoria, porque el quilo comprime al pulmón.
El examen físico debe incluir el reconocimiento de los diferentes factores de riesgo para quilotórax tales como hallazgos dismórficos, obstrucción de la vena cava superior o malformaciones linfáticas en cualquier parte.
El quilotórax congénito que se presenta antenatalmente puede actuar como una lesión que ocupa espacio y causar restricción del desarrollo fetal de los pulmones, produciéndose algún grado de hipoplasia pulmonar. El recién nacido tiene dificultad respiratoria. El 50 % de los pacientes tienen síntomas en las primeras 24 horas de vida y el resto tendrá manifestaciones clínicas al final de la primera semana de vida. Los hallazgos de matidez uni o bilateral y escasa entrada de aire se encuentran en el examen físico. El paciente con quilotórax crónico asociado a malformaciones de los linfáticos pulmonares puede presentar pérdida de peso, pérdida de masa muscular, otros signos de malnutrición y tener compromiso inmunológico por la depleción de linfocitos e hipogammaglobulinemia.
DIAGNÓSTICO
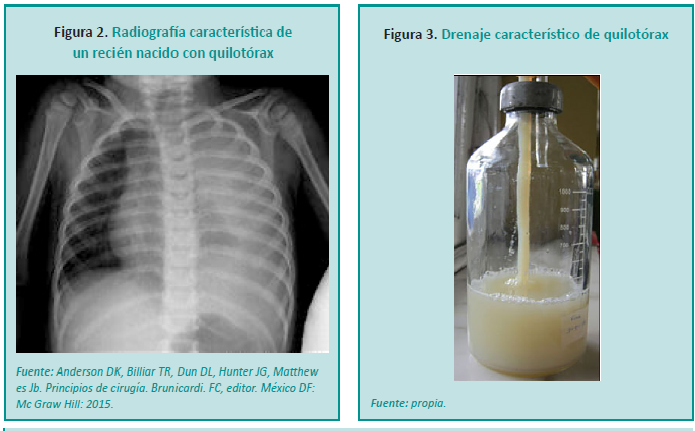
La radiografía de tórax permite identificar el derrame pleural, determinar el tamaño y la localización (Figura 2). La toracocentesis es un método sencillo y seguro para obtener líquido pleural y puede revelar la presencia de quilo mediante su análisis.
El quilo que se obtiene al realizar la toracocentesis es blanco, inoloro y de apariencia lechosa. Cuando se obtiene este tipo de líquido, se debe diferenciar entre un empiema y un quilotórax. El aspecto lechoso del empiema es causado por la suspensión de glóbulos blancos. Si se centrifuga el líquido, el sobrenadante será claro. Los derrames pleurales quilosos permanecen opacos después de la centrifugación. Una manera sencilla de diagnosticar el quilotórax es midiendo los niveles de colesterol y triglicéridos en el líquido pleural. Si el nivel de triglicéridos es superior a 110 mg/dl y la relación entre el valor de colesterol del líquido pleural y el suero es de 1:1, se establece el diagnóstico de quilotórax (Tabla 1).7
Si aún existe alguna duda si la efusión pleural es un quilotórax, se debe analizar el líquido buscando quilomicrones que pueden verse usando la tinción de Sudán. Esta tinción requiere una preparación citológica especial del líquido pleural por lo que puede no estar disponible en todos los centros. La demostración de los quilomicrones es el hallazgo clave y confirma el diagnóstico de quilotórax. En el quilotórax congénito, el líquido pleural es seroso, pero se vuelve lechoso cuando se inicia la alimentación con leche. En todo RN con derrame pleural debe solicitarse en el análisis del líquido pleural triglicéridos y lipoproteínas.8
TRATAMIENTO Y MANEJO DEL QUILOTÓRAX
La aproximación al manejo del quilotórax es la misma independientemente de la causa. Los seis principios básicos del manejo del quilotórax son el drenaje inicial, las modificaciones dietéticas con una dieta libre de grasa y con triglicéridos de cadena media o la nutrición parenteral total, la administración de somatostatina o análogos sintéticos como el octreotide, la cirugía, la prevención y manejo de las complicaciones y el tratamiento de la causa subyacente.9
Drenaje inicial
El paso inicial en todos los casos es la aspiración del líquido pleural. La primera toracocentesis se realiza con fines diagnósticos; sin embargo, si el tamaño del derrame compromete la respiración y/o es probable que sea recurrente, debe colocarse un tubo pleural para el drenaje continuo de líquido pleural (Figura 3). Cuantificar el drenaje es de utilidad para determinar la mejoría clínica y también como una guía para el clínico en relación al desbalance de líquidos (Figura 4). Algunos centros han adoptado un acercamiento terapéutico con el drenaje diario para la mejoría o la falla del tratamiento clínico. Menos de 10 ml/kg/día indica mejoría; más de 10 ml/kg/día, muestra falla en el tratamiento, después de cuatro semanas de tratamiento no quirúrgico.10